[생물학] Ch.6 - Energy and Life
Energy and Metabolism
에너지(Energy)란 일을 할 수 있는 능력이다. 이는 새로 만들어지거나 소멸하지 않으며, 형태만 바뀔 뿐이다. 에너지의 형태에는 운동 에너지, 열에너지, 퍼텐셜 에너지, 화학 에너지 등이 있다. Metabolism(물질 대사)는 생체 내에서 일어나는 모든 화학 반응의 총칭으로, 물질 대사를 통해 생명체 속 물질과 에너지의 형태가 바뀐다.
물질 대사에는 거대 분자인 Enzyme(효소)이 촉매로 관여하며, 여러 단계로 이루어진 Metabolic pathway(대사 경로)에 따라 반응이 일어난다는 특징이 있다. 대사 경로 중 큰 물질을 작은 물질로 분해하는 것을 catabolism(동화 작용)이라 하고, 작은 물질을 큰 물질로 합성하는 것을 anabolism(이화 작용)이라 한다.
에너지의 전환은 열역학 법칙을 따라 일어나는데, 그중 열역학 제 1법칙은 우주의 에너지 총량은 일정하며, 에너지는 생성되거나 소멸하지 않는다는 것이다. 한편 열역학 제 2법칙은 에너지의 전환이나 전달은 전체 계의 엔트로피(Entropy), 즉 무질서한 정도를 증가시키는 방향으로 일어난다는 것이다. 열역학 제 2법칙에 따라 에너지를 투입하지 않고도 스스로 일어나는 반응 과정을 spontaneous process(자발적 과정)이라 한다.
Gibbs Free Energy
Gibbs free energy, 혹은 free energy(자유 에너지)는 어떤 계가 특정한 온도와 압력이 유지될 때 일을 할 수 있는 에너지의 양을 말한다. 화학 반응에서 Gibbs free energy의 변화량은 다음의 식으로 산출된다.
여기서 H는 계의 엔탈피, T는 절대 온도, S는 엔트로피이다. 화학 반응에서 를 측정하면 그 반응이 자발적인지 아닌지 파악할 수 있다. 인 경우에만, 즉 free energy가 반응을 거치며 감소하는 경우에만 반응이 자발적으로 일어난다.
에너지가 감소하는(에너지를 방출하는) 반응을 exergonic reaction(발열 반응), 에너지가 증가하는(에너지를 흡수하는) 반응을 endorgonic reaction(흡열 반응)이라 한다.
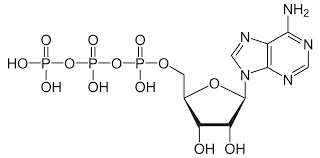
ATP(Adenosine Triphosphate)
ATP는 염기, 당과 3개의 phosphate group으로 이루어져 있다. phsphate group들 사이 결합이 가수 분해를 통해 분해될 때, 표준 조건에서 약 7.3kcal/mol (30.6kJ/mol)의 에너지를 방출한다. 이러한 고에너지를 저장할 수 있다는 점으로 인해, ATP는 생명체에서 자발적이지 않은 반응이 일어나는 데에 필수적인 분자이다. 그런데, ATP의 에너지는 어떻게 다른 화학 반응에 전달될까?
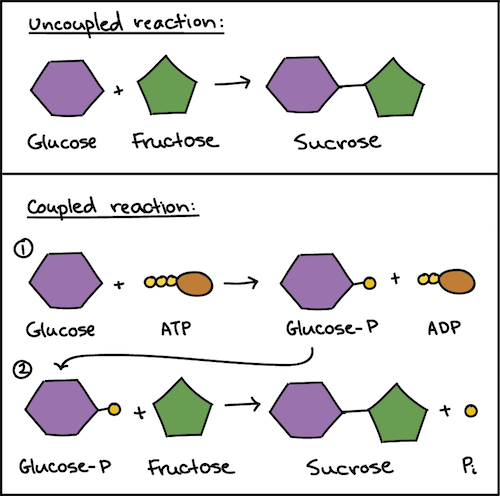
이는 비자발적 반응이 ATP의 분해 반응과 짝지어져(coupled) 일어난다. 먼저 비자발적 반응의 반응물이 ATP로부터 고에너지 인산기를 받아 phosphorylation(인산화)되는데, 이를 phosphorylated intermediate(인산화 중간체)라고 한다. 이는 원래 반응물보다 자유 에너지가 높고 반응하기 쉽다. 따라서 화학 반응이 일어나게 되고, 생성물에서 무기 인산기가 떨어져 나간다. 이로써, ATP를 통해 비자발적 반응이 일어나게 된다. 아래 그림은 설탕이 합성되는 반응에 ATP가 관여하는 모습이다. (이미지 출처: [3])
ATP는 Transport protein(수송 단백질), Motor protein(운동 단백질) 등과 결합해 단백질의 형태를 바꿈으로써 이들의 움직임에 관여하기도 한다. 그렇게 하나의 세포는 1초당 1천만 분자의 ATP를 사용한다고 한다! ADP와 무기 인산으로 분해된 ATP는 세포 호흡 등의 exergonic reaction을 통해 다시 ATP로 합성된다.
Enzymes
Catalyst(촉매)란 화학 반응에 소모되지 않으면서 반응의 속도를 높이는 물질이다. Enzyme(효소)는 생명체 안에서 촉매로 작용하는 거대 분자들을 말한다.
생명체 내에서 일어나는 화학 반응은 대개 여러 단계를 거치는데, exergonic reaction이더라도 반응물보다 중간 생성물의 에너지가 높은 경우, 그 에너지 '장벽'을 뛰어넘어야 반응이 일어날 수 있으며, 뛰어넘기 위해 필요한 에너지를 activation energy(활성화 에너지)라고 한다. 효소는 활성화 에너지를 낮추어 자발적 반응이 더 빠르게 일어날 수 있도록 돕는 작용을 하며, 이를 catalysis(촉매 작용)라 한다.
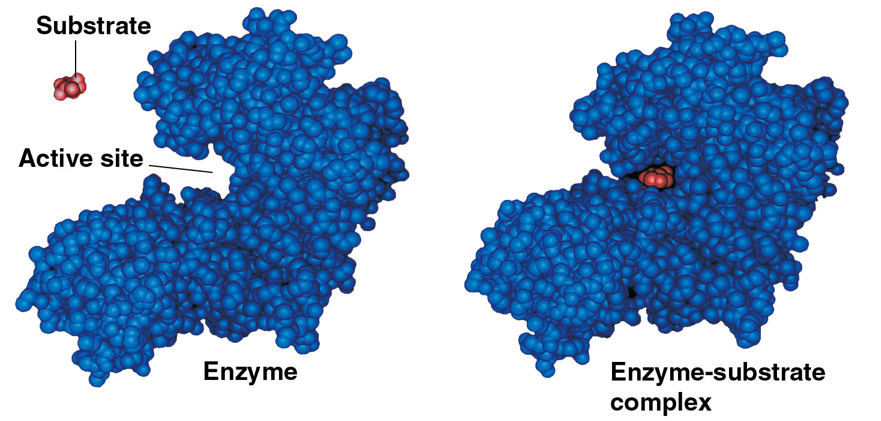
효소가 결합하여 반응을 돕는 물질을 substrate(기질)이라 한다. 효소는 기질과 결합하여 enzyme-substrate complex(효소-기질 복합체)를 형성함으로써 촉매 작용을 한다. 효소는 특정 기질과만 결합하고, 효소의 특정 부위에만 기질이 결합할 수 있는데, 이를 active site(활성 부위)라 한다. 효소는 거대한 단백질 분자이기에 고유한 3차원 구조를 가져 이러한 특성이 나타난다. 또한, 기질이 효소에 결합했을 때 효소의 모양이 바뀌어 기질과 효소가 더욱 밀착되기도 하는데, 이를 induced fit(유도 적합)이라 한다.
효소는 단백질이므로, 온도와 pH에 크게 영향을 받는다. 인체의 대부분의 효소는 섭씨 35~40도에서 가장 활발하게 작용한다. 효소는 그 외에도 다양한 환경적 영향을 받는다.
Cofactor(보조 인자)는 단백질이 아닌 분자 중 효소에 결합하여 효소의 작용에 도움을 주는 물질들을 말한다. 이들은 금속 원자일 수도, 유기 분자일 수도 있다. 유기 분자인 경우엔 이들을 coenzyme(조효소)라고 부르기도 한다. 대표적 예시로, 조효소로 작용하거나 조효소의 재료가 되는 비타민이 있다.
Enzyme inhibitor(효소 저해제)는 효소와 결합하여 효소의 작용을 방해하는 분자들을 말한다. 이중 competitive inhibitor(경쟁적 저해제)는 효소의 active site에 결합하여 기질이 결합하지 못하게 함으로써 효소의 작용을 방해하고, noncompetitive inhibitor(비경쟁적 저해제)는 효소의 다른 부위에 결합하여 효소의 구조를 변형시킴으로써, 간접적으로 active site에 기질이 결합하지 못하게 한다.
Regulation of Enzyme Activity
생명체는 효소가 언제, 어디서 작용할지 조절하는 수단들을 가지고 있다. Allosteric regulation은 효소의 특정 부위가 다른 부위에 결합한 분자에 의해 변화함으로써 효소의 작용이 조절되는 것을 의미한다. 이 방식으로 조절되는 효소의 특정 부위에 activator가 결합하면 기질이 결합할 수 있는 형태로 효소가 안정화되고, inhibitor가 결합하면 기질이 결합할 수 없는 형태로 효소가 안정화된다.
특히, activator가 해당 효소의 기질 자체로써, 효소의 한 subunit에 기질이 결합해 다른 subunit에도 기질이 결합할 수 있게 하는 작용을 cooperativity라 한다.
Feedback inhibition은 효소의 촉매하는 반응의 생성물이 저해제가 됨으로써 반응이 과도하게 일어나는 것을 막는 조절 작용이다.
References
- Campbell, N. A., Urry, L. A., Cain, M. L. et al. 『Biology: A Global Approach』. 12th ed. Pearson Education Ltd.(2021). p144-161
- https://en.wikipedia.org/wiki/Gibbs_free_energy
- https://www.khanacademy.org/science/ap-biology/cellular-energetics/cellular-energy/a/atp-and-reaction-coupling